酶消化法检测PCR产物原理同上。双酶消化鉴定如何描述实验现象1,同步双酶消化同步双酶消化是一种省时省力的常用方法,单酶切一般只用于鉴定,当然,单酶切效率更高,更简单,但弊大于利,真正应用还是要用双酶切。酶消化需要培养大肠杆菌和提取质粒,他的原理是什么。

理论上是可以的,但在成本和时间上不可行;而且,DNA不是唯一的,同卵双胞胎的DNA是一样的。如果每个人都把自己的DNA序列输入数据库,就像我们的身份证一样。理论上是可以找到的。理论上是可以的,但是地球这么庞大的人口,估计还没调查完就耗光了。在很多情况下,DNA 鉴定起到了关键作用。在这些情况下,有许多不同的方法来提取DNA。

PCR(聚合酶链反应):类似于DNA的自然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。步骤:PCR由三个基本反应步骤组成:①模板DNA的变性:模板DNA加热到93℃左右一定时间后,模板DNA的双链DNA或PCR扩增形成的双链DNA解离,从而可以与引物结合,为下一轮反应做准备;(2)模板DNA与引物的退火(复性):模板DNA加热变性为单链后,温度降至55℃左右,引物与模板DNA单链的互补序列配对结合;③引物延伸:DNA模板引物偶联物,在TaqDNA聚合酶的作用下,以dNTP为反应原料,靶序列为模板,根据与半保守复制原理的碱基配对,合成与模板DNA链互补的新的半保守复制链,重复循环变性退火延伸三个过程,获得更多的“半保守复制链”,这个新链可以成为下一个循环的模板。

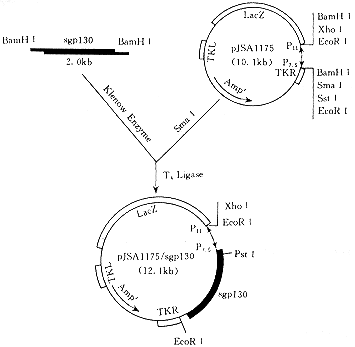
双酶切是用两种酶切割,两个酶切位点,因为单酶切自切割后会形成自组装,相当于质粒切割时质粒和质粒的自重组,因为形成的粘性末端是一样的,双酶切可以避免这种情况,连接时可以更有效的获得所需的重组DNA。当然,现在在实验室使用双酶是可行的。单酶切一般只用于鉴定。当然,单酶切效率更高,更简单,但弊大于利,真正应用还是要用双酶切。
4、如何验证载体质粒的酶切位点已被切开?PCR产物(目的基因质粒酶切后,电泳会产生与酶切位点数量相同的条带,可以用来判断质粒是否被切割。酶消化法检测PCR产物原理同上。如果是实际使用的话,可以试一个链接就知道了,或者电泳的时候点一个未切割的进行对比,迁移率会不一样。酶消化产物的电泳,质粒作为对照,如果完全切割,只有一条带位于质粒带之下,其大小通过参考标记来确定。PCR产物酶切时,如果切下的部分较小,不容易分辨,但一般情况下酶切后条带会变细变整齐;
菌落pcr速度快,可以做多次,但容易出现假阳性,一般用于初筛;质粒提取酶消化法是一定的方法,但耗时较长,通常是定型的。酶消化需要培养大肠杆菌和提取质粒。缺点是耗时,优点是结果可靠。菌落PCR只需将接种针或小枪头浸入菌落或菌液中,然后接入PCR系统,即可通过PCR判断目标条带的存在。优点是可以很快得到结果,缺点是可能会有假阳性。
6、双酶切 鉴定实验现象怎么描述1。同步双酶消化同步双酶消化是一种省时省力的常用方法。选择能使两种酶同时作用的最佳缓冲液是非常重要的一步。NEB中的每一种酶都是随酶而来的。2.分步消化如果找不到适合两种酶的缓冲液,只能用分步消化。单个酶切的电泳道上会有几个亮带。而且你根据基因大小选择的波段也不一定是你想要的。原因是单酶消化形成的粘性末端完全一样,就像拼图一样,除了内容不同,两边完全一致。
双酶消化一般有三个带,只有一个正确的现象应该是很亮的。因为两种酶识别两个位点的切割,无论是质粒两端的粘端还是目的片段完全不同,还是拼图,内容不同,两端也不同,除了一种连接方式外没有其他联系。凝胶路线上的三条带是:靶片段带、空质粒带和最亮重组质粒带。
7、重组质粒双酶切 鉴定既然你的质粒已经提出来了,就不需要考虑感受态、转化等因素了。看双酶切后载体的位置有多少条带,如果有两条带,说明酶消化不完全。如果有一条带,说明酶消化效率没问题,pET28a的分子量是5.6k,你插入的片段是500bp。如果你的质粒被完全切割,载体与插入片段的摩尔比为1: 1,质量比为5.6k:0.5k,凝胶运行后两条带的亮度比为10:1,那么你的目标带很亮,很正常。







