CaC2如何制作?CaC2它和水起什么反应?化学方程式为CaC2 2H2OC2H2 Ca(OH)2。2 CaCO3 2 CaCO3 c 3 CO2 ↑(电炉加热2000℃)化学性质:电石分子式为CaC2,分子量为64.10,工业产品为灰色、棕褐色或黑色固体,电石含量高的为紫色。

可以参考以下三种方法进行检查:1。注水法适用于检查Kipp发电机或类似于Kipp发电机的装置。首先,关闭排气管,从顶部漏斗注水。当漏斗下端被水封闭后,再次注水,水位不下降,说明该装置气密性良好。如果水位下降,说明设备气密性差。2.闭气法以初中时制备二氧化碳或氢气的简易装置为例(也可用于凯普发生器),将连接导管的橡胶管与止水夹住,向长颈漏斗中加水,直至长颈漏斗中的水位高于大试管中的水位。如果液位一段时间不变,气密性就好。

3、碳化钙可以制取乙炔么,怎么制取
电石可以产生乙炔。化学方程式为CaC2 2H2OC2H2 Ca(OH)2。在实验室里,电石与水反应生成乙炔。与水的反应相当激烈,可以通过分液漏斗调节气体出口速度来控制水的加入。也可以用饱和盐水。原理是电石发生水解反应生成乙炔。该装置是一个烧瓶和一个分液漏斗(不能使用Kipp发生器)。瓶子里放棉花,防止泡沫溢出。收集方法为排水集气法或向下集气法。

乙炔的分子式为C2H2,俗称风煤、电石气。它是炔烃化合物系列中最小的成员,主要用于工业用途,尤其是焊接金属。乙炔在室温下是一种无色且高度易燃的气体。纯乙炔无臭,但工业乙炔有大蒜味,因为其中含有硫化氢、磷化氢等杂质。乙炔可用于照明、焊接和切割金属(氧乙炔焰),也是制造乙醛、醋酸、苯、合成橡胶和合成纤维的基本原料。
4、乙炔分子是直线分子,是什么的实验,怎么检验的乙炔又称电石气体,是最简单的炔烃,结构简单HC≡CH。化学式C2H2分子结构:C原子通过sp杂化轨道结合,分子为线性非极性分子。乙炔的实验室制备方法在实验室中,常用电石与水反应制备乙炔。由于电石中含有少量的硫化物和磷化物,生成的乙炔因为混有硫化氢和磷化氢而有难闻的气味。
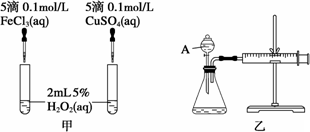
可以让反应更稳定。通常,乙炔发生器由一个烧瓶(或广口瓶)和一个插有分液漏斗和直角导气管的双孔塞组成。检查装置气密性后,将几片电石放入烧瓶中,从分液漏斗中滴入水(或饱和盐水)生成乙炔。把电石和水的反应式写成:CaC2 H2O → C2H2 ↑ Cao是错误的。曹参不可能是钙的最终产物,但Ca(OH)2(CaO水化)是最终产物是合理的。正确的化学式应该是:CaC2 2H2O→C2 H2 ↑ Ca(OH)2为了获得纯净的乙炔,
5、碳化钙( CaC2碳需要四个电子才能稳定,每个钙一个,其余由碳碳之间的三个键形成。电子:ca2 纯乙炔是一种无色无味的气体,而由电石制备的乙炔气,由于其中含有硫化氢气体或磷化氢气体,往往会有臭味!去除方法是:将气体通过硫酸铜溶液或氢氧化钠溶液!不能用浓硫酸去杂质,因为浓硫酸有很强的氧化性,容易氧化乙炔。生成的乙炔,CaC2 2H2O Ca(OH)2 HC≡CH↑杂质主要是H2S、PH3和H2O,可依次用CuSO4溶液和浓硫酸除去。
6、 CaC2怎么制取?也就是电石由生石灰和焦炭在电炉中加热至2000℃而成,学名为电石。因为是在电炉里炼出来的,所以取了个不科学的名字叫电石。2 CaCO3 2 CaCO3 c 3 CO2 ↑(电炉加热2000℃)化学性质:电石分子式为CaC2,分子量为64.10。工业产品为灰色、棕褐色或黑色固体,电石含量高的为紫色。电石新断口有光泽,暴露在空气中因为吸水而呈灰白色。
工业产品一般含电石80%。熔点是2300℃,能导电,纯度越高越容易导电。化学性质非常活泼,在适当的温度下能与许多气体和溶液发生反应,遇水剧烈分解产生乙炔气和氢氧化钙,并放出大量热量。高温下能与氯、氯化氢、硫、磷、乙醇发生剧烈反应,电石是有机合成工业的重要基础原料。乙烯、氯丁橡胶、氰氨化钙、醋酸和三氯乙烯可由电石乙炔制得,电石也用作钢铁和金属切割和焊接的脱硫剂。







